
羊骨髓淋巴细胞分离液试剂盒
产品名称: 羊骨髓淋巴细胞分离液试剂盒
英文名称: Sheep bone marrow lymphocyte separator kit
产品编号: P6120
产品价格: 0
产品产地: 北京市通州区马驹桥联东U谷134A
品牌商标: solarbio
更新时间: 2024-12-31T10:51:29
使用范围: null
北京索莱宝科技有限公司
- 联系人 : 索莱宝-龚思雨
- 地址 : 北京市通州区中关村科技园区通州园金桥科技产业基地景盛南四街15号85A三层
- 邮编 : 101102
- 所在区域 : 北京
- 电话 : 178****1073 点击查看
- 传真 : 点击查看
- 邮箱 : 3193328036@qq.com
- 二维码 : 点击查看
羊骨髓淋巴细胞分离液试剂盒 规格:3×200 mL/kit 保存:本产品对光敏感,应该室温避光储存,保质期 2 年。无菌开封后,保存于室温。 组成: 各种动物骨髓淋巴细胞分离液 200mL 全血及组织稀释液 200mL 细胞洗涤液 200mL 淋巴细胞分离方法 1. 制备骨髓的单细胞悬液。 2. 取一支适当的离心管,加入与骨髓单细胞悬液等量的分离液(分离液最少不得少于3 mL,总体积不能超过离 心管的三分之二,否则会影响分离效果)。 3. 小心吸取单细胞悬液加于分离液液面上,注意保持两液面界面清晰。(可以使用巴氏德吸管吸取单细胞悬液, 然后小心的平铺于分离液上,因为两者的密度差异,将形成明显的分层界面。) 4. 室温,500~900g,离心20~30min。(根据骨髓单细胞悬液的量确定离心条件,单细胞悬液量越大,离心力越 大,离心时间越长,具体离心条件可以自行摸索,以达到最佳分离效 果)。 5. 离心后,此时离心管中由上至下细胞分四层。第一层为稀释液层;第 二层为环状乳白色淋巴细胞层;第三层为透明分离液层;第四层为红 细胞层。 6. 用吸管小心吸取第二层环状乳白色淋巴细胞层至另一洁净的15mL离 心管中,向离心管中加入10ml细胞洗涤液洗涤白膜层细胞,250g,离 心10min。 7. 弃上清,5mL的PBS或细胞清洗液重悬细胞,250g,离心10min。 8. 重复步骤7 9. 弃上清,细胞重悬备用。 骨髓单细胞悬液的制备方法 小动物骨髓的采集: 1. 处死动物,无菌提取股骨和胫骨,剪去两端软骨,露出红色的骨髓腔(注意尽可能少的剪走骨髓腔)。 2. 取1ml的无菌注射器,吸取少量的含有10%标准胎牛血清的稀释液或者是含有血清的培养基,冲洗骨髓腔以获 得骨髓。 3. 最终制备成2×10 8–1×10 9 /ml 的单细胞悬液备用。 大动物骨髓的采集: 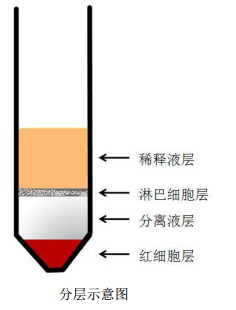 大动物骨髓的采集可采取活体穿刺方法:先将动物麻醉、固定、局部除毛、消毒皮肤,然后估计好皮肤到骨 髓的距离,把骨髓穿刺针的长度固定好。操作人员用左手把穿刺点周围的皮肤绷紧,右手将穿刺针在穿刺点垂直 刺入,轻轻左右旋转将穿刺针钻入,当穿刺针进入骨髓腔时常有落空感。连接注射器缓慢抽吸骨髓组织,当注射 器内抽到少许骨髓时即停止抽吸。用含10%标准胎牛血清的稀释液调整细胞浓度为2×10 8–1×10 9/ml 的单细胞悬 液备用。 常用的骨髓穿刺点: 股骨:穿刺部位在股骨内侧面,靠下端的凹面处; 胸骨:穿刺部位是胸骨体与胸骨柄连接处; 肋骨:穿刺部位是第5~7肋骨各点的中点; 胫骨:穿刺部位是股骨内侧、靠下端的凹面处。如果穿刺采用的是肋骨,穿刺结束后要用胶布封贴穿刺孔,防止 发生气胸。 注意事项: A. 开封前颠倒混匀,本分离液为无菌产品,为延长分离液保存时间,请在无菌条件下启封,避免微生物污染。 B. 分离液使用时应始终保持室温(18℃~25℃),如室内温度较低,可将分离液预热。4℃或者是温度较低的条 件下离心,可能会导致白膜层中红细胞污染加重。 C. 待分离的组织要求新鲜,避免冷冻和冷藏。 D. 部分塑料制品(如聚苯乙烯)因其带有的静电作用,可能会导致细胞挂壁影响分离效果。 E. 如果要进一步对分离的细胞进行培养,那在制备单细胞悬液和分离过程中,注意无菌操作,避免微生物污染。 参考文献: 1. Boyum A. Separation of leucocytes from blood and bone marrow. Scand J Clin Lab Invest Suppl. 1968; 97: 7. 2. Ting A, Morris PJ. A technique for lymphocyte preparation from stored heparinized blood. Vox Sang. 1971 Jun; 20(6): 561-3. 3. Boyum A. Separation of Blood Leucocytes,Granulocytes and Lymphocytes Tissue Antigens. 1974; 4(4): 269-74. 4. Weisbart RH, Webb WF, Bluestone R, Goldberg LS. A simplified method for lymphocyte separation. Vox Sang. 1972; 23(5): 478-80. 相关产品:
大动物骨髓的采集可采取活体穿刺方法:先将动物麻醉、固定、局部除毛、消毒皮肤,然后估计好皮肤到骨 髓的距离,把骨髓穿刺针的长度固定好。操作人员用左手把穿刺点周围的皮肤绷紧,右手将穿刺针在穿刺点垂直 刺入,轻轻左右旋转将穿刺针钻入,当穿刺针进入骨髓腔时常有落空感。连接注射器缓慢抽吸骨髓组织,当注射 器内抽到少许骨髓时即停止抽吸。用含10%标准胎牛血清的稀释液调整细胞浓度为2×10 8–1×10 9/ml 的单细胞悬 液备用。 常用的骨髓穿刺点: 股骨:穿刺部位在股骨内侧面,靠下端的凹面处; 胸骨:穿刺部位是胸骨体与胸骨柄连接处; 肋骨:穿刺部位是第5~7肋骨各点的中点; 胫骨:穿刺部位是股骨内侧、靠下端的凹面处。如果穿刺采用的是肋骨,穿刺结束后要用胶布封贴穿刺孔,防止 发生气胸。 注意事项: A. 开封前颠倒混匀,本分离液为无菌产品,为延长分离液保存时间,请在无菌条件下启封,避免微生物污染。 B. 分离液使用时应始终保持室温(18℃~25℃),如室内温度较低,可将分离液预热。4℃或者是温度较低的条 件下离心,可能会导致白膜层中红细胞污染加重。 C. 待分离的组织要求新鲜,避免冷冻和冷藏。 D. 部分塑料制品(如聚苯乙烯)因其带有的静电作用,可能会导致细胞挂壁影响分离效果。 E. 如果要进一步对分离的细胞进行培养,那在制备单细胞悬液和分离过程中,注意无菌操作,避免微生物污染。 参考文献: 1. Boyum A. Separation of leucocytes from blood and bone marrow. Scand J Clin Lab Invest Suppl. 1968; 97: 7. 2. Ting A, Morris PJ. A technique for lymphocyte preparation from stored heparinized blood. Vox Sang. 1971 Jun; 20(6): 561-3. 3. Boyum A. Separation of Blood Leucocytes,Granulocytes and Lymphocytes Tissue Antigens. 1974; 4(4): 269-74. 4. Weisbart RH, Webb WF, Bluestone R, Goldberg LS. A simplified method for lymphocyte separation. Vox Sang. 1972; 23(5): 478-80. 相关产品:
R1018 细胞洗涤液 S9020 优级胎牛血清 R1017 全血及组织稀释液 31800 RPMI Medium 1640 T1300 胰蛋白酶-EDTA消化液(0.25%)不含酚红 YA0902 一次性巴氏德吸管 各种其他动物及其他细胞的分离液及试剂盒
