
编者按
预测局部晚期肺癌患者或转移性肺癌患者对化疗或靶向治疗的临床应答,需要一种准确且可负担的工具。在本研究中,研究人员利用了主要来源于恶性浆液渗出物的肺类器官模型(LCOs),准确预测了晚期肺癌患者对治疗的临床应答。
今天,我们关注一项广东省人民医院吴一龙教授、杨衿记教授团队于2023年在Cell子刊Cell Reports Medicine(IF:16.988)发表的最新研究——《Using patient-derived organoids to predict locally advanced or metastatic lung cancer tumor response: A real-world study》,该研究利用肺类器官模型,根据其病理和分子特征验证模型的可靠性,并利用药物敏感性试验(DSTs)的结果,制定了晚期肺癌的个性化治疗策略,这也是目前全球范围内已公开发表的zui大的肺癌类器官研究队列。
论文翻译:曾玲玲
01、研究背景
肺癌是诊断量第二大的癌症,也是导致癌症死亡的主要原因,在中国每年有超过60万人死于肺癌。发展出恶性浆液性积液(MSE)的晚期肺癌患者的预后情况明显较差,总生存期(OS)为5.49个月,而没有MSE的患者为12.65个月。一种基于个性化因素和特定基因靶点制定治疗方案的方法已被开发出来,以提高治疗效果。分子靶向疗法延长了晚期肺癌患者的生存期,提高了患者的生活质量。
目前,个性化治疗方案的确定在很大程度上依赖于分子分析方法的结果,特别是下一代测序(NGS)。NGS可以检测肿瘤驱动突变,然后使临床医生选择特定的分子靶向药物进行癌症治疗。分子测序历来依赖于手术和穿刺活检标本。研究表明,在恶性胸腔积液(MPE)样本中检测表皮生长因子受体(EGFR)突变的敏感性和特异性与在肿瘤组织样本中进行的测量相当(>80%)。此外,MPE是检测kirsten大鼠肉瘤病毒癌基因同源物(KRAS)突变和间变性淋巴瘤激酶(ALK)重排的可靠样本。使用MSE也可以检测到任何新获得的基因改变。
肺癌是一种复杂的疾病,在不同的患者中表现出表型和基因型的多样性,这给精准医学的应用带来了相当大的挑战。非小细胞肺癌(NSCLC)是研究最广泛的肺癌亚型,尽管只有30%的患者携带可操作突变,但并非所有这些患者都能从靶向治疗中获益。另外,一些靶向抗癌药物也有脱靶作用,还有,一些没有可操作突变的患者可能受益于靶向治疗药物,如EGFR酪氨酸激酶抑制剂(TKIs)或聚(ADP核糖)聚合酶(PARP)抑制剂。因此,建立模拟原始组织形态学和基因组特征的临床前模型来预测靶向治疗的临床结果势在必行。
建立可靠的临床前模型来评估肿瘤对化疗或靶向药物的应答一直是人们关注的焦点。这些模型包括细胞系,基因工程小鼠模型,器官型组织切片培养,和患者来源的异种移植物(PDXs)。虽然传统的肿瘤细胞系可以用来建立临床前模型,但由于缺乏细胞间的相互作用,它们不足以代表复杂的肿瘤。相反,PDX可以保留原始肿瘤的结构和遗传特征,并模拟类似的肿瘤微环境。然而,PDX和基因工程模型都既昂贵又耗时,而且需要牺牲大量的实验动物。因此,一个易于维持和扩增的临床前模型对于转化医学至关重要。患者来源的类器官(PDOs)使用三维结构,可以准确模拟肿瘤的异质性和多样性,与原始临床标本显示出高度的基因型和表型一致性,对抗肿瘤药物的应答反应可以模仿患者的预期反应,并且可以在短时间内获得结果。
在以往的研究中,一系列器官的原发肿瘤已成功构建了类器官,包括结肠、子宫、卵巢、胰腺、乳腺等实体肿瘤。近年来,来自原发性肺肿瘤的类器官也有报道。过去,手术标本被用来建立肺癌类器官(LCOs),但这不易用于晚期肺癌。除了LCO的建立和验证之外,研究还侧重于开发自动化方法,如微阵列和微流控芯片,以便在短时间内进行基于类器官的药物测试。最近的一项研究表明,使用肺腺癌(ADC)类器官进行靶向治疗的应答结果与实际临床应答高度相关,揭示了LCOs作为个性化医疗工具的潜力。
LCO培养的成功率在7%~87%之间,MSE可能是一个理想的来源。然而,基于LCO的药敏试验(LCO-DST)预测临床应答的准确性尚不清楚。在这项研究中,本文研究人员成功地从肿瘤组织标本和MSE样本中生成了160个LCOs。本文研究人员的目标是利用肿瘤组织或MSE样本生成可行的LCO模型,并根据其病理和分子特征验证模型的可靠性,利用药物敏感性试验(DSTs)的结果制定晚期肺癌的个性化治疗策略。
02、主要研究成果
1、肺癌患者源性类器官的构建及病理分析
在本研究中,从2019年10月1日至2021年9月30日期间从107名晚期癌症患者中收集了214份用于生成类器官的样本。本文研究人员成功建立了162个PDOs(图1A),成功率为75.7%。在排除了两名乳腺癌患者的样本后,160个样本最终被纳入后续深入分析。这些LCOs包括127例ADCs,10例鳞状细胞癌(SCCs),小细胞肺癌(SCLCs),12例腺鳞癌(ASCs),1例肺肉瘤癌。本组中的LCOs主要来自MSE(162例中的132例),包括胸膜液样本(103例)、腹水样本(15例)和心包积液样本(14例)。此外,从手术切除的原发性或转移性病变活检中分离出18个标本,主要来自淋巴结。
本文研究人员试图分析52例LCOs培养失败的潜在原因。其中细胞不足是最常见的因素之一。此外,单因素和多因素分析显示,病理和采样类型是独立的影响因素。使用肺腺癌和MSE更有利于培养成功。
采用苏木精-伊红(H&E)染色和免疫组化(IHC)对类器官进行验证,并与原始组织进行形态学和病理学比较。免疫组化标记物选自常规用于肺癌亚型诊断的。H&E染色(图1B)和IHC(图1C-1E)显示LCOs保留了原始肿瘤组织或MSE的组织病理学特征。例如,ADC衍生的LCOs聚集在一起,具有微妙的细胞学特征,如突出的核和立方核形态,能形成腺泡结构,并保留了原发ADC组织的特征(图1B)。
此外,ADC衍生的LCOs会表达经典的ADC标志物,包括细胞角蛋白7(CK7)、甲状腺转录因子1(TTF-1)和napsin A(图1C)[43]。SCC衍生的LCOs来自手术切除的肺病变(P-106),其IHC指标P40、P63和CK5/6表达强烈(图1D)。而来源于SCLC的LCOs细胞形态小,周质少,可以表达CD56、突触素(Syn)、CgA和TTF-1等神经内分泌标志物(图1E)。这些数据表明,LCOs可以保持原发肿瘤的形态学和病理学特征,并反映其个体特征。
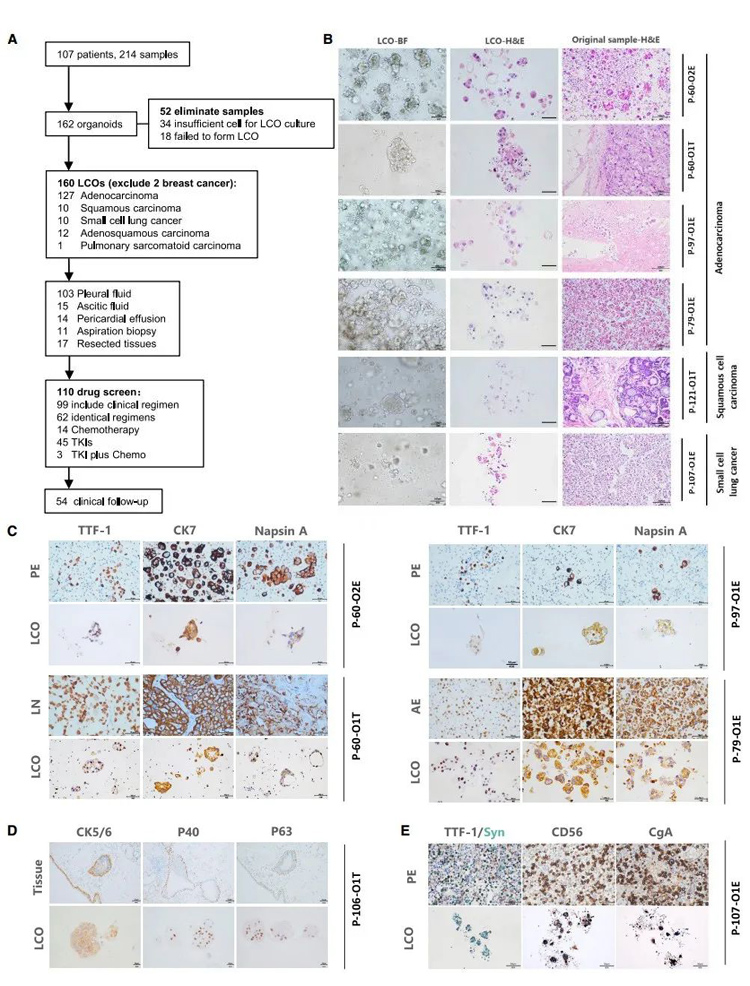
原文图1 LCOs构建流程图及其病理学分析
2、MSE与MSE衍生LCOs基因组图谱的一致性
对25例患者进行了NGS检测,以检测LCOs与原始样本之间基因谱的一致性。对积液和LCO样本进行体细胞突变谱分析。积液中的变化和与之相匹配的LCO样本的变化,如图A所示。
总的来说,在积液样本中鉴定出共有157个体细胞变异,其中涉及到77个基因,包括100个单核苷酸变异(SNVs)、11个indels、28个拷贝数变异(CNVs)、4个大基因组重排(LGRs)和14个融合子。肿瘤蛋白53(TP53)、EGFR和视网膜母细胞瘤1(RB1)是最常见的突变基因,分别出现在69%(n=18)、69%(n=18)和19%(n=5)的积液样本中。
此外,在LCO样本中鉴定出143个体细胞突变,涉及73个基因,包括93个SNVs、11个indels、26个CNVs、4个LGRs和9个融合子。EGFR、TP53和RB1是最常见的突变基因,分别发生在65%(n=17)、58%(n=15)和15%(n=4)的LCO样本中。在这些变异中,64个突变(30.9%)为积液特异性,50个(24.2%)突变是LCO特异性的,93个(44.9%)突变在两种介质中共有。积液和LCO样品的变异检出率具有可比性(96.2% vs 80.7%,p=0.19)。
在积液和LCO样本中,最大等位基因频率的中位数无显著差异(31.1%对34.0%,p=0.98,图2B)。接下来,分析了MSE和LCOs之间体细胞变异的一致性。在20例存在体细胞变异的积液和LCO样本中,在积液和LCO样本中均检测到93例体细胞变异,39例为积液特异性变异,41例为LCO特异性变异。当以匹配的积液样本的基因组图谱作为参考时,这些数据导致LCO样本的变异敏感性为70.5%(132例中有93例),阳性预测率为69.4%(134例中有93例,图2C)。11例匹配的LCOs和积液标本存在肿瘤突变负荷(TMB)。在两种介质之间观察到相似的TMB(两者均为1.99个突变/Mb,p=0.89,图2D)。此外,基于LCO的TMB与基于积液的TMB呈正相关‘(图2E)。
总的来说,这些发现揭示了积液和LCO样本之间的基因组图谱可接受的一致性。
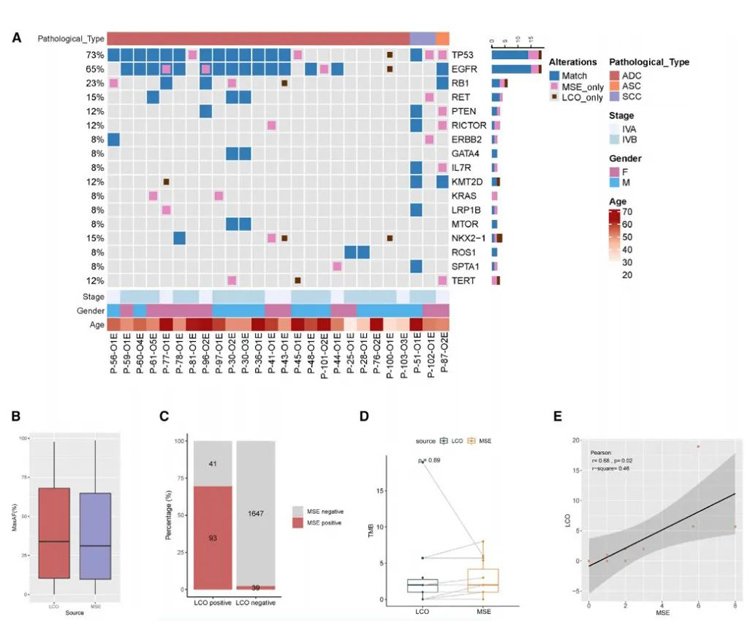
原文图2 LCO样本的基因组分析
3、LCOs可预测对靶向治疗的个性化应答
在大多数患者中,治疗方案是基于遗传特征和既往治疗等因素进行个性化的。此外,体外药物筛选策略也针对个别患者量身定制。将临床方案与LCO-DST结果相同的36例患者的54例LCOs分为4类:奥西替尼组、化疗组、双靶向治疗组和其他靶向治疗组。
通过受试者工作特征曲线(ROC)分析LCO-DST来区分临床敏感或耐药患者的能力。预测指标是LCO对奥西替尼、化疗、双靶向治疗和其他靶向治疗的敏感性。应答的一致性分别为86.7%(13/15)、83.3%(10/12)、100%(10/10)和70.6%(12/17),LCODST的总体敏感性为84.0%(95%CI, 63.08%-94.75%),特异性为82.8%(95%CI, 63.51%-93.47%),准确性为83.3%(图3A、3B)。来自4例患者的6个LCOs的药物反应热图显示,患者对抗癌药物的反应存在个体差异,而来自同一患者的不同LCOs之间的反应具有相对较高的一致性。化疗药物的半数最大抑制浓度(IC50)值一般高于靶向治疗剂。
在奥西替尼组中,12例患者选择奥西替尼作为下一线治疗药物(图3C),并对这些患者产生的15例LCOs进行了奥西替尼敏感性测试(图3D)。一般情况下,进展组(PD)和部分缓解组(PR)的IC50可以明显区分,ROC分析的曲线下面积(AUC)值为0.94(图3E和3F)。使用LCO-DST可以准确预测大多数患者的临床反应。例如,P-41被诊断为EGFR 19del的IVA期ADC。一线治疗是伊可替尼。PD后,LCO-DST提示奥西替尼的潜在有益作用(IC50=0.10 μM)。在现实中,奥西替尼用于该患者的后续治疗,并实现了持续的PR(图3G)。
此外,LCO-DST还可以预测对靶向治疗药物的耐药性。EGFRT790M被发现,并且根据临床指南选择奥西替尼作为下一步治疗药物。然而,LCO-DST显示体外对奥西替尼耐药(IC50=4.37 μM)。遗憾的是,该疾病仅在4.5个月的时间内便迅速发展(图3H)。此外,这些结果表明肿瘤体积的减小与IC50值相关,表明该方法也可以预测抗癌治疗后的预后情况。
4例ALK融合患者被纳入LCO-DST分析,包括1例未治疗患者和3例治疗患者。所有LCO-DST结果均与临床反应一致(100%,5/5)。例如,P-63被诊断为IVA期ADC,其含有棘皮微管相关蛋白样4(EML4)-ALK融合基因。第二代ALK-TKIs,色瑞替尼和SAF-189s,先后实现了33.7和22.8个月的PFS。在进行二线治疗进展后,使用MPE样本进行LCO-DST来预测对艾乐替尼的耐药性。SAF-189s在体外也无效(图3I和3J)。然而,在决定下一步治疗方案时,并未考虑LCO-DST;艾乐替尼仍被确定为三线治疗药物。颅内转移瘤显著增加,这导致疾病的恶化。另一个病人ALKfusion(P-27)先前对艾乐替尼有耐药性,在LCO-DST中显示对艾乐替尼不敏感。
这些结果表明,LCOs可以预测未经治疗和接受治疗的患者对靶向治疗的临床反应。尽管每种药物试验的方案是有限的,可能无法准确表明哪种治疗方法更好,但对于这些患者来说,可以避免因不必要的副作用、时间消耗和资源消耗而导致的无效治疗仍然至关重要。
4、LCOs预测对化疗的个性化反应
LCO药物筛选试验结果与对化疗的真实临床反应之间的相关性已有报道。在这里,本文研究人员报告了9名被推荐化疗作为下一步的疗程的患者的数据。其中,4例患者患有ADC,并接受了TDM1(P-85),nab-紫杉醇(P-81),培美曲塞和卡铂(P-25)和EP治疗(依托泊苷和顺铂)(P-3)的治疗。4例SCLC患者中有3例接受EP治疗(P-50、P-65和P-83),P-73接受nab-紫杉醇治疗。
在接受EP治疗的患者中,P-3被诊断为ADC,而其他患者被诊断为SCLC。他们采用相同的治疗方案,但结果不同。P-3和P-65均达到PR,而P-50和P-83均达到PD。实际的临床反应是由LCO-DSTs预测的,EP治疗抑制了P-3和P-65衍生的LCO,但未能抑制P-50和P-83衍生的LCO(图3K)。这些结果提示,LCOs对化疗药物的体外检测可以反映临床对化疗的反应。
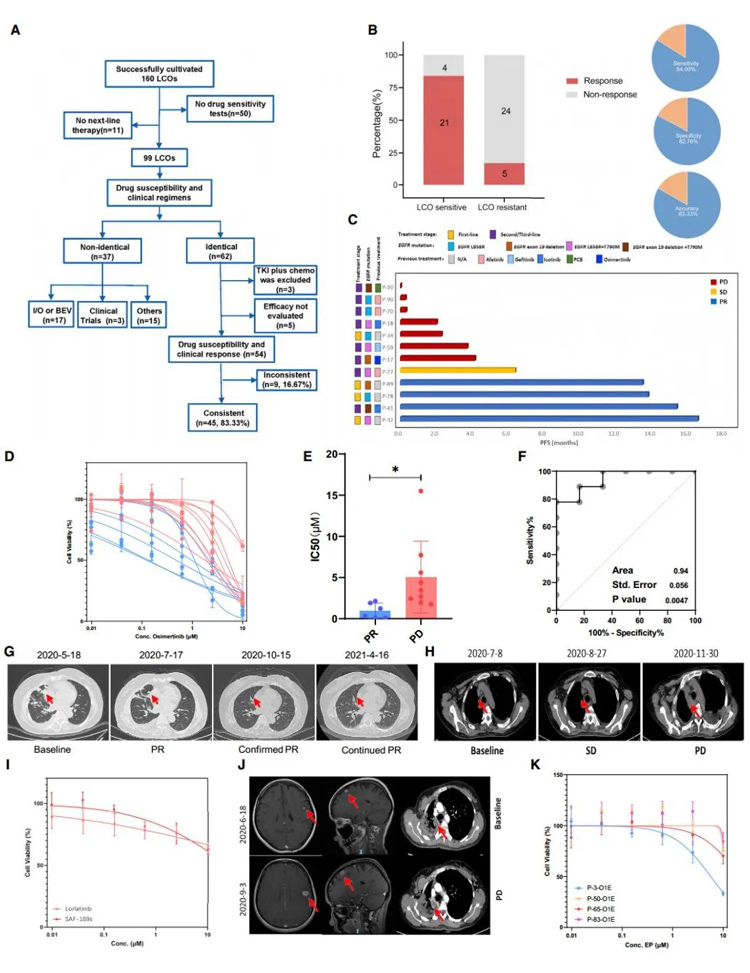
原文图3 基于LCO的药物筛选与临床应答的比较
5、从多个样品中得出的LCOs显示出稳定性和异质性
除了模型的成功率和纯度之外,使用肿瘤类器官进行药物筛选的另一个挑战是实验稳定性。肿瘤间和肿瘤内的异质性已被广泛考虑。在本研究中,本文研究人员收集了来自同一患者的不同样本,以探索LCO药物反应的稳定性和异质性。首先,提取患者不同时间点的MSE样本,建立LCOs,并进行DSTs。
随着采样时间的延长,细胞数量呈减少趋势,但不影响LCO模型的建立。对不同培养时间LCO样品进行基因组图谱分析。不同采样时间间隔为1~9天。P-51在第1、2、3天采集了3份LCO样本。P-78和P-100分别在第1天和第2天采集了2个LCO样本。P-101在第4天和第9天采集了两个LCO样本。对于P-51,3个LCO的体细胞变异一致性为81.25%(16个LCO中的13个),仅在第1天收集的LCO中检测到MYC扩增和WT1扩增,而在第3天收集的LCO中未检测到IL7R扩增。此外,从其余三名患者(P-78、P-100、P101)获得的LCO样本中也观察到相同的变化。总的来说,这些发现表明在不同采样时间获得的LCO样本之间的基因组谱具有高度一致性,这表明LCO可能是一种优化的稳定的NSCLC体外模型(图4A)。
接下来,本文研究人员研究了来自5名患者的组织样本、积液样本和LCOs基因组图谱的一致性。在P-51中,肿瘤组织样本中检测到13个SNVs,在MSE和LCOs中均检测到12个SNVs;然而在MSE和LCOs中仅检测到12个CNVs中的2个(图4B)。在P-87和P-96中也观察到组织和积液/LCO样本之间SNVs的高度一致性(图4C和4D)。在P-60和P-100中观察到组织和积液/LCO样本之间CNVs的一致性较低(图4E和4F)。这些发现表明SNVs,而不是CNVs,可以在积液/LCO样品中被准确地检测到。
在连续样品中,LCO的体外药物反应保持稳定。P-51患有晚期SCC,连续3天收集了大量MPE。MPE的细胞密度随着时间的推移而下降,类器官形成的数量也受到影响,尽管LCO培养物中的细胞密度保持不变(图4G)。LCO-DST对不同样品的检测结果稳定。nab-紫杉醇联合对3种LCOs的抑制作用最小,临床上也被证明无效,而磷酸肌苷3-激酶(PI3K)的抑制剂GDC-0941的抑制作用更强(图4H和4I)。从MSE样品中获得的LCOs似乎与组织来源的LCOs有很大的差异,例如从P-33的MPE中获得的LCOs松散且不规则。来自同一患者淋巴结的LCOs形状更紧密,更规则(图4J)。
淋巴结来源的LCOs对DST也更敏感(图4K),接受艾乐替尼治疗的患者临床评价达到PR,与药敏试验结果一致(图4L)。在不同MSE样品的情况下,LCO-DST往往表现出相同的剂量-效应关系。例如,从MPE和腹水积液中采集两个样本,LCOs的形态特征略有不同:MPE来源的LCOs呈液泡状和实状,而腹水积液来源的LCOs呈实状(图4M)。腹水积液来源的LCOs的DST敏感性略高于MPE来源的LCOs,但两者敏感性差异不显著(图4N)。
原文图4 LCO的稳定性和异质性
6、LCO药物筛选可代表双靶向治疗的临床反应
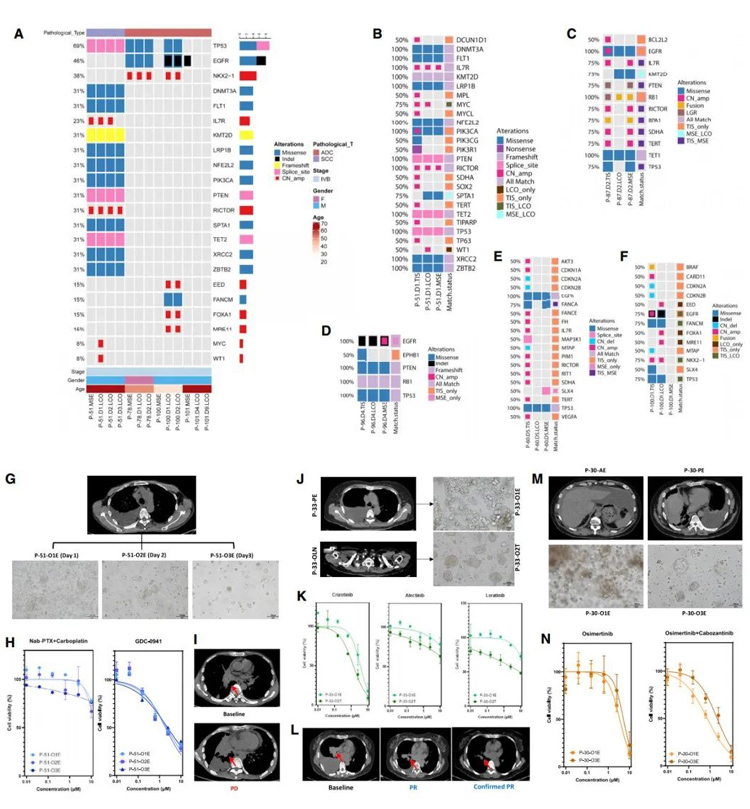
在晚期肺癌患者中,对单一抗癌药物的耐药性是常见的。LCO-DST对体外预测联合治疗效果有一定的指导意义。在本研究中,有几个病例表现为进行性肺部疾病。获得LCOs,并对联合治疗方案进行测试。P-60诊断为IVB期肺ADC(图5A),基线时脑脊液中检测到EGFR L858R突变和MET拷贝数增加。
该患者服用奥西替尼后出现头晕、呕吐加重伴脑转移灶扩大;看来奥西替尼可能不是最佳选择。成功培养了一个淋巴结来源的LCO(P-60-O1T),三个心包积液来源的LCO(P-60-O2E、P-60-O3E和P-60-O4E)分别在第1、4、5天,并进行DST(图5B)。在这4种LCOs中,奥西替尼联合赛沃替尼的IC50分别为1.32、0.71、0.25和0.24。对比奥西替尼(1.82、1.15、0.25、1.30)和赛沃替尼(仅在P-60-O3E和P-60-O4E中进行,分别为11.59和17.61)的IC50,结果显示,对于该患者,奥西替尼联合沙伐替尼可能优于奥西替尼或沙伐替尼单药治疗。
有趣的是,由于MET扩增在MSE和LCO中通过荧光原位杂交(FISH)、免疫荧光染色和免疫组化(IHC)被进一步证实(图5C、5D),并证实了PR(图5E),所以给予患者奥西替尼联合赛沃替尼治疗。P-61被诊断为IVA期肺ADC,基线是EGFR 19del(图5F)。患者因获得性T790M突变,而接受了伊可替尼的一线治疗和奥西替尼的二线治疗。在出现耐药性后,患者接受了双靶向治疗,包括奥西替尼和卡博替尼。双药联合治疗45天后肿瘤评估显示PR(图5G)。
NGS证实在转染(RET)-CCDC6融合过程中,除了EGFR 19del和T790M外,还存在重排蛋白(图5H)。同期胸腔积液(P-61-O1E、P-61-O2E、P-61-O3E)和腹水积液(P-61-O4E、P-61-O5E)来源的LCOs的DST显示,奥西替尼联合卡博替尼的IC50分别为0.15、0.22、0.16、0.33、0.44,而奥西替尼联合BLU667的IC50分别为0.03、0.02、0.01、0.03、0.24,表明奥西替尼联合卡博替尼/BLU667可显著抑制肿瘤生长(图5I)。这些病例提示LCO-DST具有预测有效联合治疗方案的潜力。
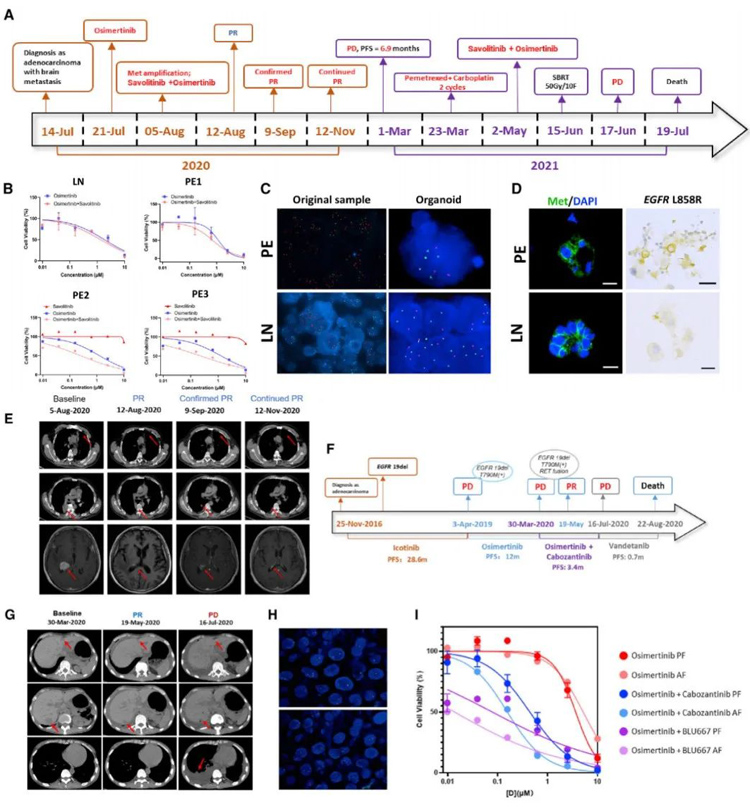
原文图5 LCOs预测耐药病例的双靶向治疗
7、LCOs的蛋白质组学图揭示了双靶向治疗的分子机制
尽管EGFR和RET抑制剂联合治疗的效果已在LCO药物筛选试验中得到证实,但其潜在的分子机制尚不清楚。因此,选择进行4Dlabel-free高通量蛋白质组学分析。本文研究人员在287,153个光谱中鉴定出39,312个独特的肽段。总共鉴定了4865个蛋白质,其中4833个被定量。
将定量蛋白又分为4组(4818、4787、4785和4833),类器官分别用奥西替尼、BLU-667联合奥西替尼、BLU-667(联合组)和0.1%二甲亚砜处理。主成分分析(PCA)结果显示,不同处理组的表达水平不同,表明不同的效应(图6A)。在差异表达蛋白(DEPs)方面,与对照组相比,联合治疗有119个蛋白发生了显著改变,包括26个上调蛋白和93个下调蛋白(图6B)。然而,当使用单一药物奥西替尼或BLU-667治疗时,DEPs的数量分别为154个(图6C)和285个(图6D)。从DEPs的细胞定位上来看,三个处理组的蛋白表达趋势相同,其中DEPs中核蛋白数量最多,其次是细胞质蛋白和细胞膜蛋白。这些结果表明,三种处理方式对蛋白表达的改变旨在调节细胞核功能,包括基因表达。
就DEPs的功能而言,几个蛋白家族的改变与肿瘤细胞的存活密切相关。奥西替尼与BLU-667联用后,导致触发细胞凋亡的关键因子caspase 3的表达显著增加,而caspase家族其他成员caspase 8、caspase 10的表达在经联合方案处理后表达也增加(图6E)。由于常见的下游级联反应,RET重排是EGFR-TKI耐药的关键因素。RET TKIs还联合第三代EGFR-TKI奥西替尼作为EGFR-RET双突变患者的治疗方案。
然而,潜在的分子机制尚不清楚。通过4D液相色谱-串联质谱(LC-MS/MS)的蛋白质组学分析显示,EGFR和RET的下游蛋白如RAC、PI3K、MEK的表达下调(图6F),表示其参与了肿瘤细胞存活。治疗中改变的另一个关键通路是Hippo通路,该通路对肿瘤的生长和存活至关重要。BLU-667和奥西替尼单独或联合治疗均显著降低了MOB1和MST1/2水平。在BLU-667和奥西替尼联合治疗后,存活相关基因的关键转录因子YAP水平下降(图6G)。这些结果表明,与单一试剂处理相比,联合处理会显著触发细胞死亡的情况。
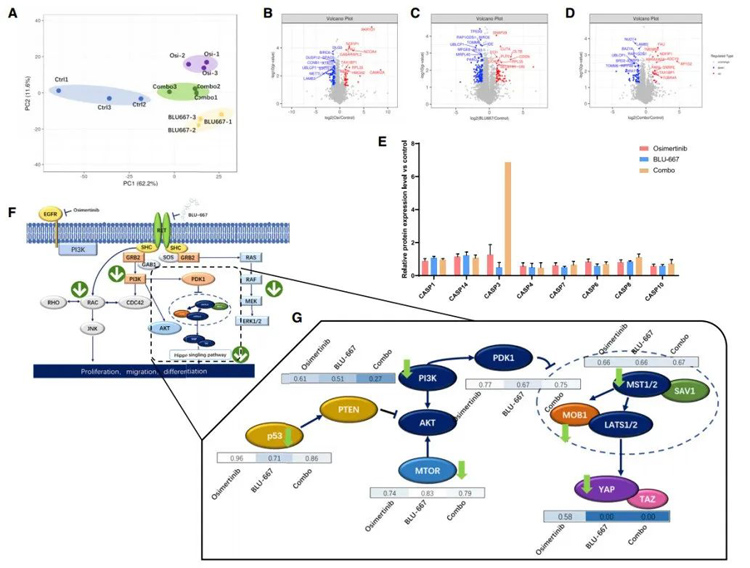
原文图6 胸膜液衍生类器官的蛋白质组学分析表明耐药机制
03、编者点评
根据遗传谱和其他生物标志物的结果制定治疗策略存在局限性[44,45]。在许多情况下,特别是对原发性耐药患者,对治疗反应的分子机制或缺乏分子机制尚不清楚。因此,在使用精准医学治疗肺癌时,寻找到可准确预测临床反应的方法势在必行。
先前的研究表明,MSE衍生的类器官和其他体外模型是预测临床治疗疗效的潜在材料。本文研究人员的研究结果表明,LCO模型为两种目标的应用提供了一个个性化的平台,对于晚期肺癌患者的治疗和化疗。在本文研究人员的队列中共建立了162个类器官,其中大部分来自MSE样本。组织源性类器官和MSE源性类器官的成功率分别为57.8%(30/52)和81.4%(132/162),这意味着MSE可以提供弥补这一成功率差距的机会。从核心穿刺活检和淋巴结切除获得的类器官培养物中,肿瘤细胞计数通常不足。此外,从手术和活检样本中获得的模型的一个限制就是正常气道上皮细胞的过度生长。
然而,MSE主要由肿瘤细胞组成,而不是非恶性上皮细胞或间皮细胞,可以通过相对微创的方式获得。因此,MSE衍生的LCOs往往是更纯粹的肿瘤类器官,使这些模型成为DST的优秀候选者。来自组织或MSE样本的LCOs真实地反映了原始肿瘤的病理和分子特征,这些结果为后续的DST提供了可靠的基础。LCO-DST结果与临床治疗反应高度一致,该方法有望作为一种重要的预测工具,可用于个性化医疗,建立个性化的肺癌治疗方案。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特类器官平台已建立人诱导多能干细胞及多种癌种的类器官培养平台,欢迎有需要的读者垂询!
参考文献
[1] Sung, H., Ferlay, J., Siegel, R.L., Laversanne, M., Soerjomataram, I., Jemal, A., and Bray, F. (2021). Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. Cancer J. Clin. 71, 209–249.
[2] Wang, N., Mengersen, K., Tong, S., Kimlin, M., Zhou, M., Wang, L., and Hu, W. (2019). Lung cancer mortality in China: spatial and temporal trends among subpopulations. Chest 156, 972–983.
[3] Porcel, J.M., Gasol, A., Bielsa, S., Civit, C., Light, R.W., and Salud, A. (2015). Clinical features and survival of lung cancer patients with pleural effusions. Respirology 20, 654–659.
[4] Pauli, C., Hopkins, B.D., Prandi, D., Shaw, R., Fedrizzi, T., Sboner, A., Sailer, V., Augello, M., Puca, L., Rosati, R., et al. (2017). Personalized in vitro and in vivo cancer models to guide precision medicine. Cancer Discov. 7, 462–477.
[5] Wu, L., Wang, Y., Xu, X., Liu, Y., Lin, B., Zhang, M., Zhang, J., Wan, S., Yang, C., and Tan, W. (2021). Aptamer-based detection of circulating targets for precision medicine. Chem. Rev. 121, 12035–12105.
[6] Hahn, W.C., Bader, J.S., Braun, T.P., Califano, A., Clemons, P.A., Druker, B.J., Ewald, A.J., Fu, H., Jagu, S., Kemp, C.J., et al. (2021). An expanded universe of cancer targets. Cell 184, 1142–1155.
[7] Wu, Y.L., Cheng, Y., Zhou, X., Lee, K.H., Nakagawa, K., Niho, S., Tsuji, F., Linke, R., Rosell, R., Corral, J., et al. (2017). Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutation-positive non-smallcell lung cancer (ARCHER 1050): a randomised, open-label, phase 3 trial. Lancet Oncol. 18, 1454–1466.
[8] Arbour, K.C., and Riely, G.J. (2019). Systemic therapy for locally advanced and metastatic non-small cell lung cancer: a review. JAMA 322, 764–774.
[9] Cobain, E.F., Wu, Y.M., Vats, P., Chugh, R., Worden, F., Smith, D.C., Schuetze, S.M., Zalupski, M.M., Sahai, V., Alva, A., et al. (2021). Assessment of clinical benefit of integrative genomic profiling in advanced solid tumors. JAMA Oncol. 7, 525–533. 2020.7987.
[10] Liu, X., Lu, Y., Zhu, G., Lei, Y., Zheng, L., Qin, H., Tang, C., Ellison, G., McCormack, R., and Ji, Q. (2013). The diagnostic accuracy of pleural effusion and plasma samples versus tumour tissue for detection of EGFR mutation in patients with advanced non-small cell lung cancer: comparison of methodologies. J. Clin. Pathol. 66, 1065–1069.
