P2X7属于嘌呤能受体家族当中的一种,其家族共被分为两大类:分别是G蛋白偶连P2Y受体和配体门控离子通道P2X受体。P2X受体主要被细胞外的ATP激活开放,而P2X7由于对ATP的亲和性较低而与其他家族中的受体略有差异。P2X7需要相较于生理浓度100-1000倍的胞外ATP浓度才能被激活,据报道其EC50值为大约100μM;但对BzATP的亲和度较高,其EC50大约为7μM。P2X7受体是一类非特异性阳离子通道,可以促进Na+和Ca2+的流入以及K+的外排,同时激活下游通路信号的产生。P2X7激活后下游最显著的效应器便是NLRP3(核寡聚结构域类似受体家族吡啶域3)炎症体。NLRP3炎症体剪切并激活caspase-1,caspase-1会继续剪切促炎症细胞因子-pro-IL-1β和pro-IL-18形成完整且具有活性的形态。长期的ATP对P2X7刺激会引起细胞膜上形成较大的孔洞,从而导致炎症细胞死亡程序。
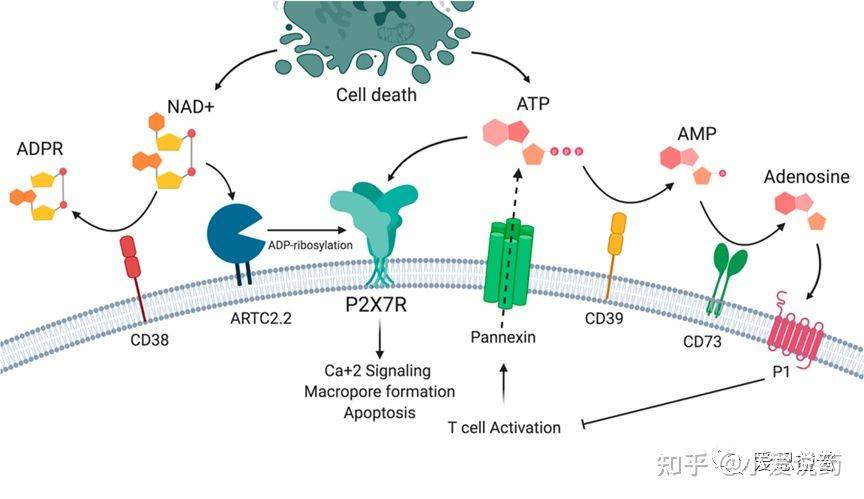
图1.P2X7受体和嘌呤能信号通路
P2X7,心血管疾病中一个尚未开发的靶点
心血管疾病是全球性的一类主要疾病,每年由于心血管疾病导致的死亡率占总体疾病的约31%。人们对于心血管疾病的讨论在世界范围内经久不衰,但是仍然鲜有极有效的治疗手段可以应用到患者身上。究其原因,是因为包括多种复杂的病理或生理相关的心血管疾病问题难以分辨。而近年来,与心血管疾病相关的炎症问题越来越多的被摆到“餐桌”上。这当中大量的研究表明,高血压,动脉粥样硬化,心肌细缺血性灌注损伤和心力衰竭是引起炎症的主要原因。因此,针对以上炎症诱因而选择的其中一个有效靶点便是P2X7受体。
P2X7这一配体门控阳离子流通道,在被胞外高浓度的ATP激活后,同时触发激活NLRP3炎性体,并导致促炎症反应产生的IL-1β和IL-18两个附加物的释放。P2X7的激活以及IL-1β和IL-18的增加便会导致诸如高血压,动脉粥样硬化,心肌缺血后再灌注损伤,心衰等相关疾病的产生。在动物模型中,小鼠P2X7受体的敲除会导致炎症反应显著减少,这也对应着疾病程度的降低,同时说明P2X7的拮抗效应可以有效降低高血压,减弱动脉粥样硬化。在临床实验当中,IL-1β和IL-18的抑制效应能有效降低心肌梗死或心衰问题的产生。
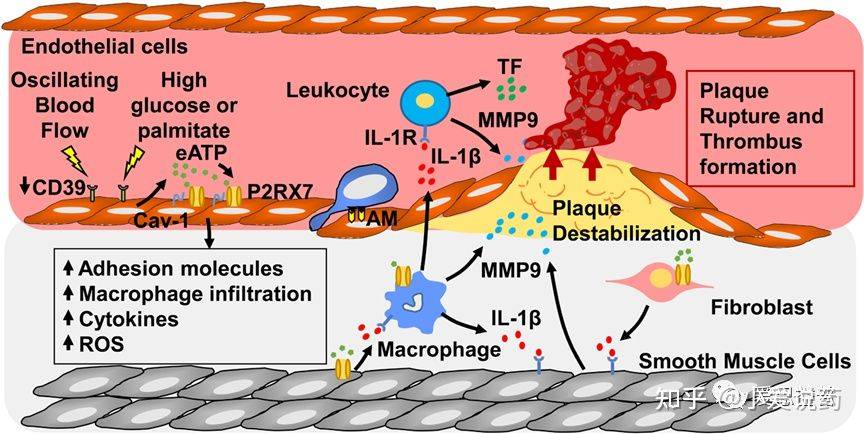
图2.P2X7和动脉粥样硬化
ATP和P2X7受体在肿瘤学中扮演的角色
P2X7受体和它的配体ATP同样被看做是参与免疫系统中实体癌和白血病生长调控的重要成员。实际上,ATP是一种危险信号,这一危险信号意味着:一种小分子物质大量的存在于细胞溶质内,而在细胞外液中较为匮乏,且会在坏死的细胞死亡时被释放出来。细胞外的ATP则会激活免疫应答作用于P2X7受体。相应地,增加细胞外液中ATP的水平会被包括化疗和放射疗法在内的抗癌治疗手段影响。在最近的一项研究中,Kamata-Sakurai和他的同事揭示了细胞外的ATP可以激活抗肿瘤治疗途径,例如一种抗CD137抗体,这一抗体可以有效抑制肿瘤活性,同时减少不必要的全身副作用。ATP还通过直接激活验证途径来调节肿瘤相关的免疫反应。或通过激活CD39和CD73外切核苷酸酶产生其降解产物腺苷而引起免疫抑制。P2X7的药理学抑制增强了T细胞的入侵,降低了CD39和CD73D 表达,因此减少了肿瘤微环境中的免疫抑制。有趣的是,在肿瘤床内P2X7受体的表达是胞外ATP水平较高的保障。也有证据表明,在携带黑色素瘤或白血病实验中,P2X7缺失的小鼠ATP浓度减少。根据促肿瘤活动,在几种肿瘤疾病当中,P2X7可以增强细胞增殖,血管再生,基质降解和转移扩散。因此,P2X7的抑制剂被证明对临床前黑素瘤模型,神经细胞瘤模型和白血病模型能起到有效减少癌症增长的作用。
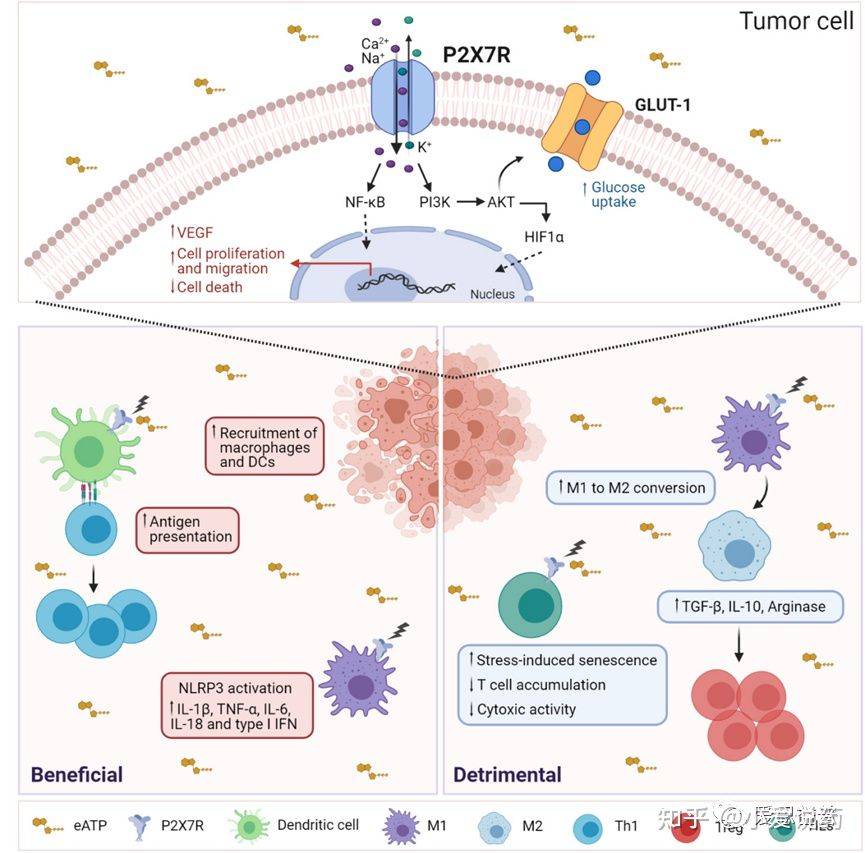
图3.P2X7受体活性在肿瘤和免疫细胞中的影响
P2X7受体在COVID-19通路中可能扮演的角色
实际上,P2X7受体在身体的多个部位均有表达,当中也包括免疫系统,肺部,中枢神经系统等。在整个COVID-19感染的过程中,ATP的释放会导致NLRP3免疫应答机制的启动。因此P2X7受体可以激活,增加免疫应答,同时调控肾素-血管紧张素醛固酮系统的释放(RAAS)相关的通路和血脑屏障(BBB)的渗透性。
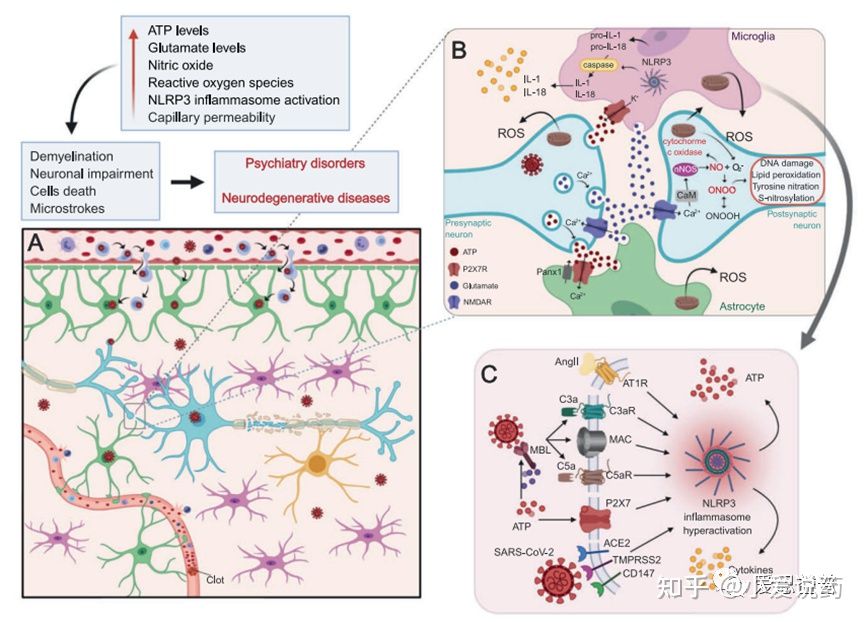
图4.P2X7受体调控中枢神经系统中由干扰SARS-CoV-2引起的神经免疫炎症
P2X7受体的激活与许多促炎症事件相关
凋亡细胞释放的ATP会结合P2X7受体,并引起Ca2+内流和K+外流。细胞内Ca2+浓度的增加,使得细胞膜上的P2X7受体和Pannexin-1形成的孔洞释放更多的ATP到细胞外。这一结果最终导致大量的ATP在细胞外聚集,细胞外的ATP浓度增加,进而激活了P2X7受体,形成一种正反馈机制。细胞外K离子会使NLRP3炎症体聚集,并因此形成pannexin-1通道。NLRP3炎症聚集体激活caspase-1,caspase-1切割IL-1β前体使之形成IL-1β并促使其外排到胞外。这一释放过程同样会发生在微囊泡、外泌体或核内体当中。骨髓干细胞可分化形成包括嗜酸性粒细胞,嗜碱性粒细胞,嗜中性粒细胞,单核细胞,树突细胞,T和B淋巴细胞等。在以上这些细胞当中,激活单核细胞内的P2X7受体可以介导释放基质金属蛋白酶(matrix metalloproteinases,MMPs)MMP-9,而MMP-9可以破坏血脑屏障(BBB)和IL-1β的释放。P2X7受体的激活介导单核细胞分化为巨噬细胞同时刺激单核细胞,巨噬细胞和树突细胞释放IL-1β和TNF-α,而IL-1β的释放会促使树突细胞迁移。T淋巴细胞中P2X7受体的激活会释放MMP-9,介导细胞迁移,使细胞分化成CD4+和CD8+T淋巴细胞,如果必要的话,树突细胞IL-1β的释放还会使CD4+细胞分化成对病原体病菌产生免疫应答的Th1,Th17和Tfh细胞。
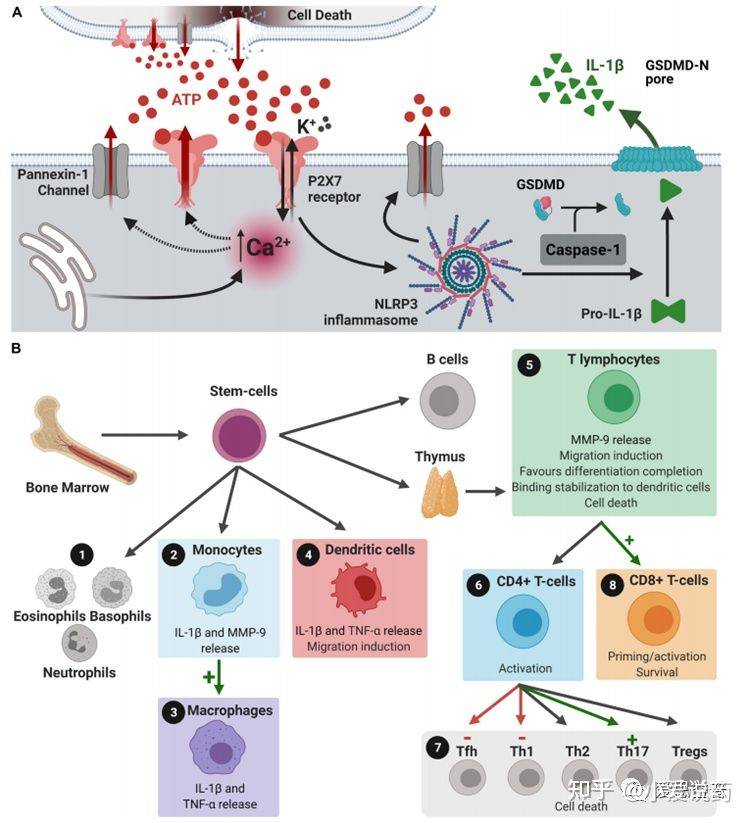
P2X7受体在神经退行性疾病中血脑屏障通透的参与过程
血脑屏障渗透通过P2X7受体信号伴随着细胞损伤进程的展开,并引起细胞凋亡,最终ATP释放进入中枢神经系统的微环境中。当ATP含量超过生理正常范围时,小胶质细胞内的P2X7受体便会被激活。进而导致介导IL-1β和其他细胞素和活性因子等的产生和释放。除此之外,激活这一通路也能提高金属基质蛋白酶的活性,引起TJ和BM蛋白降解最终破坏血脑屏障。这一系列事件发生的结果最终导致了外周免疫细胞侵袭中枢神经系统。因为T细胞和嗜中性白细胞均表达P2X7受体,所以凋亡细胞释放的大量ATP也会激活这些细胞中的这类受体。其结果是激活黏连蛋白的脱落,细胞因子和基质金属蛋白酶的产生和释放,促使炎症性和侵入性的反馈机制。在神经组织退行性疾病当中,神经凋亡的过程中也会释放高浓度的ATP到胞外环境当中。在阿尔茨海默症发病机理中,ATP结合到P2X7受体并在小神经胶质细胞中过表达,小神经胶质细胞活性依赖于P2X7受体的表达活性来对αβ多肽产生反应。P2X7受体刺激释放的IL-1β和趋化因子有助于血脑屏障渗透行,导致中性粒细胞和CD8+细胞趋化。在帕金森疾病中(PD),α突触核蛋白聚集致使多巴胺能神经元死亡,增加ATP含量水平使P2X7过度激活。α-突触核蛋白可以结合小胶质细胞中表达的P2X7受体。α-突触核蛋白和P2X7受体均和IL-1β和趋化因子的增加相关,这也意味着导致PD中神经炎症出现的情况。这种IL-1β的分泌与MMP-9释放的诱导有关,导致血脑屏障功能障碍。在血脑屏障功能障碍和趋化因子水平增加的条件下,T细胞趋化和侵入大脑薄壁组织。T细胞可以识别α-突触核蛋白抗原决定簇,释放大量的ATP并上调P2X7受体活性,使得PD症状恶化。多发性硬化症使神经脱髓鞘的特点同样和ATP水平的增加和P2X7受体过度激活相关。活跃的星形胶质细胞中P2X7受体的表达和活性上调有利于活化因子的释放和外周免疫细胞的趋化。周细胞也有P2X7受体的表达,这些受体调控内皮细胞和周细胞的相互作用以及保障血脑屏障功能的完整性。血管周围巨噬细胞的数量增加与疾病进程相关,且P2X7受体在这些疾病进程中的功能仍不清楚。多发性硬化症的表现为侵染T细胞和单核细胞,P2X7受体的表达可以启动自动免疫攻击。
总结
随着越来越多的P2X7抑制剂被验证处于安全窗口范围内,P2X7的拮抗效应会被视为具有极大潜力可以用于治疗心血管相关的疾病问题,中枢神经系统疾病以及肿瘤相关疾病在内的多种。应对这类由炎症引发的各类疾病的有效策略尚在开发当中,且仍然是一个让人非常感兴趣的途径。
结语
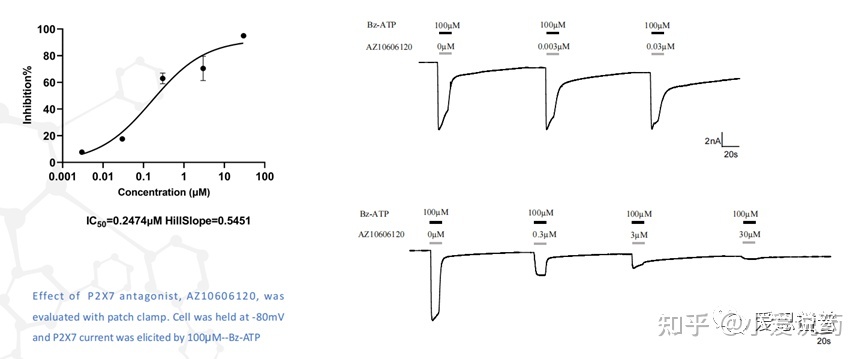
在我们实验室,构建了从FLIPR到全自动膜片钳,再到手动膜片钳的离子通道药物筛选模式,我们称之为离子通道筛选三部曲。我们实验室关于P2X7通道已在FLIPR平台进行了完整的靶点验证,包括该靶点的强效激动剂BZ-ATP和抑制剂ZA10606120。
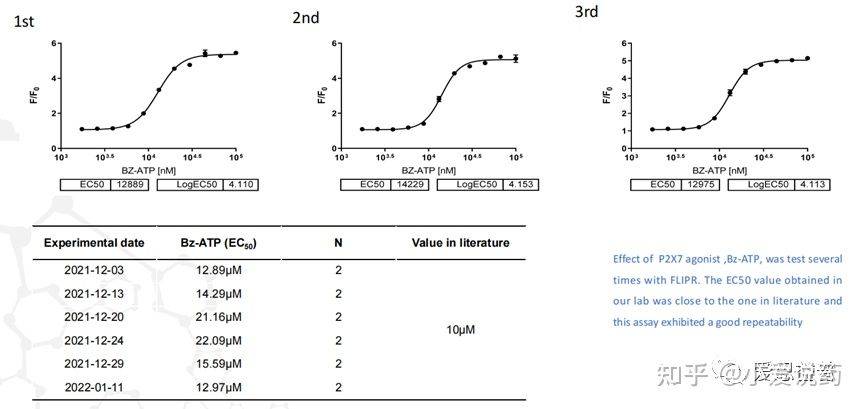
并进行了多次重复性的验证,得到了高度一致性的可靠数据。
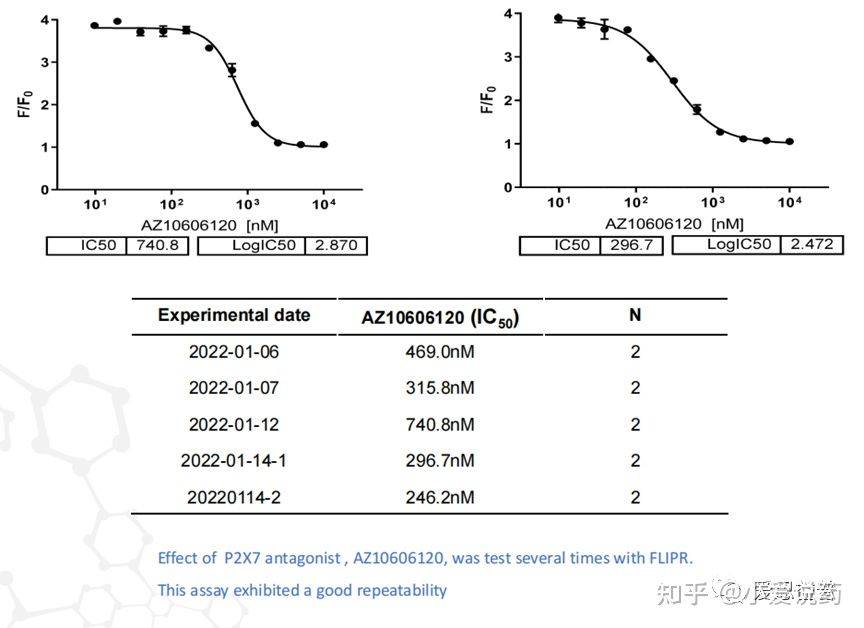
同时也应用手动膜片钳平台验证了P2X7的特异性拮抗剂AZ10606120,可以看到P2X7靶点对AZ10606120的敏感反应。
相信我们所建立的这些成熟的研究平台,积累的丰富经验,可以为相关的基础研究和新药开发,做出一份有价值的贡献。
1.World HealthOrganization. Cardiovascular Disease. https://www.who.int/ health-topics/cardiovascular-diseases/#tab=tab_1.Accessed May 28, 2020.
2.Surprenant A,Rassendren F, Kawashima E, North RA, Buell G. The cytolytic P2Z receptor forextracellular ATP identified as a P2X receptor (P2X7). Science. 1996;272:735–738.
3.Pegoraro A, De Marchi E, Adinolfi E. P2X7Variants in Oncogenesis. Cells. 2021 Jan 19;10(1):189.PMID: 33477845;
4.Di Virgilio F, Sarti AC, Falzoni S, De MarchiE, Adinolfi E. Extracellular ATP and P2 purinergic signalling in the tumourmicroenvironment. Nat Rev Cancer. 2018 Oct;18(10):601-618.
5.Di Virgilio F, Dal Ben D, Sarti AC, GiulianiAL, Falzoni S. The P2X7 Receptor in Infection and Inflammation. Immunity. 2017Jul 18;47(1):15-31.
6.Pellegatti P, Raffaghello L, Bianchi G,Piccardi F, Pistoia V, Di Virgilio F. Increased level of extracellular ATP attumor sites: in vivo imaging with plasma membrane luciferase. PLoS One. 2008Jul 9;3(7):e2599. Lecciso M, Ocadlikova D, Sangaletti S, Trabanelli S, DeMarchi E, Orioli E, Pegoraro A, Portararo P, Jandus C, Bontadini A, Redavid A,Salvestrini V, Romero P, Colombo MP, Di Virgilio F, Cavo M, Adinolfi E, CurtiA. ATP Release from Chemotherapy-Treated Dying Leukemia Cells Elicits an ImmuneSuppressive Effect by Increasing Regulatory T Cells and Tolerogenic DendriticCells. Front Immunol. 2017 Dec 22;8:1918.
7.Kamata-Sakurai M, Narita Y, Hori Y, Nemoto T,Uchikawa R, Honda M, Hironiwa N, Taniguchi K, Shida-Kawazoe M, Metsugi S,Miyazaki T, Wada NA, Ohte Y, Shimizu S, Mikami H, Tachibana T, Ono N, Adachi K,Sakiyama T, Matsushita T, Kadono S, Komatsu SI, Sakamoto A, Horikawa S, HirakoA, Hamada K, Naoi S, Savory N, Satoh Y, Sato M, Noguchi Y, Shinozuka J, KuroiH, Ito A, Wakabayashi T, Kamimura M, Isomura F, Tomii Y, Sawada N, Kato A, UedaO, Nakanishi Y, Endo M, Jishage KI, Kawabe Y, Kitazawa T, Igawa T. Antibody toCD137 Activated by Extracellular Adenosine Triphosphate Is Tumor Selective andBroadly Effective In Vivo without Systemic Immune Activation.Cancer Discov. 2021 Jan;11(1):158-175.
8.Adinolfi E, De Marchi E, Orioli E, PegoraroA, Di Virgilio F. Role of the P2X7 receptor in tumor-associated inflammation.Curr Opin Pharmacol. 2019 Aug;47:59-64.
9.Vijayan D, Young A, Teng MWL, Smyth MJ.Targeting immunosuppressive adenosine in cancer. Nat Rev Cancer. 2017 Nov22;17(12):765.
http://10.De Marchi E, Orioli E, Pegoraro A, SangalettiS, Portararo P, Curti A, Colombo MP, Di Virgilio F, Adinolfi E. The P2X7receptor modulates immune cells infiltration, ectonucleotidases expression andextracellular ATP levels in the tumor microenvironment. Oncogene. 2019May;38(19):3636-3650.
http://11.De Marchi E, Orioli E, Pegoraro A, SangalettiS, Portararo P, Curti A, Colombo MP, Di Virgilio F, Adinolfi E. The P2X7receptor modulates immune cells infiltration, ectonucleotidases expression andextracellular ATP levels in the tumor microenvironment. Oncogene. 2019May;38(19):3636-3650.
12.Adinolfi E, Raffaghello L, Giuliani AL,Cavazzini L, Capece M, Chiozzi P, Bianchi G, Kroemer G, Pistoia V, Di VirgilioF. Expression of P2X7 receptor increases in vivo tumor growth. Cancer Res. 2012Jun 15;72(12):2957-69.
13.Yang C, Shi S, Su Y, Tong JS, Li L. P2X7Rpromotes angiogenesis and tumour-associated macrophage recruitment byregulating the NF-κB signalling pathway in colorectal cancer cells. J Cell MolMed. 2020 Sep;24(18):10830-10841.
14. Jelassi B, Chantôme A, Alcaraz-Pérez F,Baroja-Mazo A, Cayuela ML, Pelegrin P, Surprenant A, Roger S. P2X(7) receptoractivation enhances SK3 channels- and cystein cathepsin-dependent cancer cellsinvasiveness. Oncogene. 2011 May 5;30(18):2108-22.
15.Di Virgilio F, Falzoni S, Giuliani AL,Adinolfi E. P2 receptors in cancer progression and metastatic spreading. CurrOpin Pharmacol. 2016 Aug;29:17-25.
16.Shokoples BG, Paradis P, Schiffrin EL. P2X7Receptors: An Untapped Target for the Management of Cardiovascular Disease.Arterioscler Thromb Vasc Biol. 2021 Jan;41(1):186-199.
17. Ribeiro DE, Oliveira-Giacomelli Á, Glaser T,Arnaud-Sampaio VF, Andrejew R, Dieckmann L, Baranova J, Lameu C, Ratajczak MZ,Ulrich H. Hyperactivation of P2X7 receptors as a culprit of COVID-19neuropathology. Mol Psychiatry. 2021 Apr;26(4):1044-1059.
18.Pegoraro, A., De Marchi, E., Ferracin,M. et al. P2X7 promotes metastatic spreading and triggersrelease of miRNA-containing exosomes and microvesicles from melanomacells. Cell Death Dis 12, 1088 (2021).
19.Oliveira-Giacomelli Á, Petiz LL, Andrejew R, Turrini N,Silva JB, Sack U and Ulrich H (2021) Role of P2X7 Receptors in Immune ResponsesDuring Neurodegeneration. Front. Cell. Neurosci. 15:662935.
公司介绍
关于爱思益普北京爱思益普生物科技股份有限公司2010 年成立,专注于从先导化合物筛选,优化到临床前候选分子阶段基于细胞和生化的药物体外筛选技术和早期药物机理研究,关注肿瘤,免疫,心血管,中枢神经系统等疾病领域的生物学和药理学研究技术,打造创新型CRO+的探索者。爱思益普关注新药研发企业对速度、效率和结果的需求,用专业的技术和高效的沟通帮助客户提高新药研发的效率。
爱思益普致力于建立全面的靶点筛选和体外生物学研究平台,建立一系列基于生物学和药理学的研究技术集群,为客户提供涵盖各种靶标和疾病领域的新药研发服务,包括从活性化合物发现,靶标验证,先导化合物优化到临床前候选药物的选择。公司建立了100+离子通道,100+GPCR,800+酶学靶点以及40+核受体筛选细胞系及验证方法,涵盖了大部分成药性靶点,在国内具有**水平和竞争优势。公司建立了蛋白纯化,生化酶学,肿瘤细胞学,免疫学,电生理学,心脏体外研究,中枢神经系统药理学,药物脱靶效应筛选,药物心脏安全性评价,ADME等平台,全面支持创新药研发的DMTA(设计,合成,测试,分析)一体化服务。爱思益普为国内新药研发机构超过600家以上机构提供服务,得到客户广泛好评。
