编者按:
病毒感染是人类疾病的主要原因。虽然中枢神经系统(CNS)具有免疫豁免权,但其仍可以对病毒的入侵做出积极的反应。CNS抵御病原体入侵的第一道防线是中枢屏障系统的保护,病原体跨越血脑屏障或血脑脊液屏障需要特殊的方式。尽管大多数病毒在外周组织中复制,但目前许多病毒已经进化出入侵神经系统的策略(表1)。病毒通常是进入外周神经系统,并通过轴突纤维到达中枢神经系统。外周神经系统由连接中枢神经系统和周围组织的神经纤维和神经节组成。由于这些外周神经在中枢神经系统的保护屏障之外,比较有机会被感染利用。
除了进入周围神经系统感染CNS之外,嗜神经病毒还有许多其他方法绕过屏障系统并直接进入中枢神经系统,但CNS中有许多方式来清除入侵中枢的病毒。脑实质的小胶质细胞是中枢神经系统的免疫细胞,通过大约几个小时的高度动态检测过程,可完成一次细胞外空间的扫描,检测并清除掉大多数进入CNS的病毒。脑脊液由脉络丛中的特殊上皮细胞合成,然后流经脑室和脑膜。脉络丛、脑膜和血管周围空间不是由小胶质细胞占据,而是由源自骨髓的巨噬细胞和树突状细胞占据。巨噬细胞和树突状细胞一旦扫描到病毒入侵,就会启动强大的免疫反应清除入侵的病毒。
但是随着新的嗜神经病毒不断出现,中枢系统由于缺乏对新病毒的免疫记忆,对这些新病毒免疫抑制作用相对较弱,造成病毒的迅速传播并诱发严重的神经病理反应。因此,小编在这里给大家推荐McGavern DB和Kang SS发表在《Nature reviews Immunology》题为“Illuminating viral infections in the nervous system”的综述文章,本综述除了重点描述病毒进入和在神经系统内传播的主要策略外,还关注在病毒持续复制和潜伏状态期间的神经系统和免疫系统之间建立的对话方式。最后讨论如何使用双光子激光扫描显微镜(TPLSM)观察中枢系统的先天免疫细胞在急性病毒感染后的免疫保护和损害机制。
表1. 人类嗜神经病毒及相关动物模型
dsDNA:双链DNA;GPCMV:豚鼠巨细胞病毒;HCMV:人巨细胞病毒;HSV:单纯疱疹病毒;LCMV:淋巴细胞脉络丛脑膜炎病毒;JEV:日本脑炎病毒;MCMV:小鼠巨细胞病毒;PVR:脊髓灰质炎病毒受体;RCMV:大鼠巨细胞病毒;RT:逆转录;SHV:猿猴人类免疫缺陷病毒;SIV:猿猴免疫缺陷病毒;ssRNA:单链RNA;WNV:西尼罗病毒。
一、病毒入侵并在神经系统中的传播
1.中枢神经系统的解剖学和屏障作用
维持中枢神经系统内的稳态对于神经元和大脑功能至关重要。血脑和血脑脊液屏障有助于保护中枢神经系统免受循环系统成分的影响。大多数的脑血管都由紧密连接的内皮细胞组成,限制细胞和分子通过内皮间隙扩散到脑实质中。内皮细胞还通过产生由层粘连蛋白α4和层粘连蛋白α5组成的基底膜,为血管周围空间提供物理屏障。沿着血管分布的平滑肌细胞调节血管张力,而周细胞(一种包围全身毛细血管和静脉中内皮细胞的细胞)可以在发育过程中维持和整合血脑屏障成分。在脑实质内,血管旁的小胶质细胞和血管周围的巨噬细胞与血管内皮紧密并列,并有可能与浸润的白细胞相互作用。星形胶质细胞还通过形成神经胶质界限和星形胶质细胞末端的致密网络来维持血脑屏障系统。
图1. 脑的解剖结构
2.病毒跨越血管内皮
跨越血管内皮是病毒入侵中枢神经系统的方式之一,脊髓灰质炎病毒、爱泼斯坦-巴尔病毒(EBV)、小鼠腺病毒1(MAV-1)、人嗜T-淋巴病毒1型(HTLV1)和西尼罗河病毒(WNV)均可以直接感染人脑微血管内皮细胞系。病毒感染通常会促进趋化因子(CCL2和CCL5)的增加,改变紧密连接蛋白的表达来改变内皮细胞功能,增加血管细胞粘附分子1(VCAM1)的表达并降低跨内皮电阻。这些改变会增加血管通透性并允许病毒直接跨越中枢系统的第一层屏障作用。
此外病毒也可以与内皮细胞表达的蛋白质结合入侵这些细胞。例如,形成紧密的内皮间屏障的连接蛋白连接粘附分子A(JAM-A)是呼肠孤病毒入侵的受体蛋白。而逆转录病毒HTLV1可以和多种受体结合,包括1型葡萄糖转运蛋白(GLUT1)、硫酸肝素蛋白聚糖和神经纤维蛋白1,而这些受体在血管内皮细胞均有表达,表明HTLV1直接感染血脑屏障以入侵人类的中枢神经系统。
3.类似特洛伊木马的入侵方式
病毒入侵中枢神经系统的另一种方式是通过“特洛伊木马”机制,简单来说就是受病毒感染的白细胞,通过携带血液中的病原体穿过血脑屏障。慢病毒[SIV和HIV(人类免疫缺陷病毒)等]通常通过对单核细胞和巨噬细胞的感染,完成跨中枢神经系统血管屏障迁移。在SIV和HIV感染期间,CD16阳性的单核细胞群在外周迅速增殖,并透过血脑屏障分布到脑血管周围空间和脉络丛。
4.病毒入侵周围神经系统
病毒入侵中枢神经系统的另一种方式是通过侵染外围的感觉和运动神经元进入中枢神经系统。感觉神经元或运动神经元上病毒受体的差异表达,会导致特定放入嗜神经病毒入侵不同外周神经元的神经末梢。脊髓灰质炎病毒、腺病毒和狂犬病病毒可以与神经肌肉接头处的神经元结合。一般来说脊髓灰质炎病毒与神经元的脊髓灰质炎病毒受体(PVR,也称为CD155)结合、腺病毒和柯萨奇病毒和腺病毒受体(CAR)结合、狂犬病病毒与乙酰胆碱受体和神经细胞粘附分子(NCAM)结合。此外,疱疹病毒,包括伪狂犬病病毒,结合nectin 1(也称PVRL1)和nectin 2(PVRL2)感染感觉神经元。外周病毒入侵不仅仅局限于感觉和运动神经元,嗅觉神经也充当病毒入侵中枢系统的靶点。
5.病毒在中枢神经系统的传播
病毒到达中枢神经系统后,通过许多不同的机制来促进细胞间的传播。首先病毒可以通过释放到突触间隙或通过与邻近神经元的融合进行传播。甲型疱疹病毒入侵神经元后通过顺行运输系统,从神经元胞体移动到轴突终末,通过胞吐从突触前的终末释放到突触裂隙,感染邻近的细胞神经元。狂犬病病毒入侵神经元后,以逆轴浆运输的方式在神经元以逆行的方式传播。
图2. 病毒在中枢神经系统的入侵和传播
二、持续性和潜伏性病毒感染
一旦病毒成功入侵神经系统,就会有以下三种情况的发生,包括急性复制、持续性感染和进入潜伏期。理想的情况下,中枢的免疫系统会快速清除入侵的病毒,而不导致正常细胞的功能损伤。但是一些病毒可以避开这一阶段,进入持续性感染或潜伏期。持续性病毒感染是持续的病毒复制,而潜伏期是一种病毒休眠状态。在潜伏期间,病毒通常会整合到宿主基因组中,并产生一些免疫系统可以检测到的抗原性物质。如果免疫系统受到抑制,潜伏的病毒会重新激活,形成病毒粒子,并引发严重的中枢神经系统疾病。一般来说,在持续和潜伏期的病毒感染引起的免疫反应会对神经系统功能造成严重破坏。
1.HSV
HSV-1会对感觉神经元进行入侵,感觉神经元是周围神经系统的一部分,不在中枢神经系统血脑屏障的保护范围内。HSV-1最初感染外周细胞,然后通过逆行轴突运输进入神经元胞体。在到达细胞核后,HSV-1会进入潜伏状态,神经元基因组中保持静止状态,直到重新激活。
中枢系统对HSV的免疫防御的第一道防线,来自Toll样受体(TLR)家族对病原体相关分子模式(PAMPs)的识别。TLR2或TLR9对神经胶质细胞的响应可导致I型干扰素(IFN)、白介素15(IL-15)、肿瘤坏死因子(TNF)和趋化因子CCL2的产生,招募巨噬细胞。TLR3在神经元和神经胶质细胞表达,通过增加I型干扰素反应增强神经元对HSV-1感染的抵抗力。
除了HSV-1感染后发生的先天免疫反应外,还必须产生病毒特异性T细胞来维持HSV-1潜伏期。CD4+和CD8+T细胞分布在HSV-1潜伏感染的神经元附近,CD8+T细胞通过主要组织相容性复合体(MHC) I类依赖的相互作用防止HSV-1重新激活。HSV-1感染后,CD8+T细胞通过识别HSV-1免疫优势表位-包膜糖蛋白B(gB498-505)的498-505残基控制HSV-1病毒粒子的产生。此外CD8+T细胞释放颗粒酶B有助于控制HSV-1的重新激活。
2.HIV和SIV
病毒的持续性感染并不完全与中枢神经系统中的神经元相关。例如,HIV和SIV感染后,免疫抑制作用会导致血管周围巨噬细胞和脑实质的小胶质细胞被病毒感染。在HIV-1感染过程中,循环系统中的病毒感染的CD14+和CD16+单核细胞以特洛伊木马的方式进入中枢系统,导致中枢系统的巨噬细胞和小胶质细胞继发性持续性的感染。类似的,在HIV或SIV感染后,CD4+或CD8+T细胞数量的减少加速了疾病的病理学过程。随着疾病的发展,HIV在血管周围巨噬细胞中广泛传播,并可感染多达三分之二的脑实质小胶质细胞。由此引发的先天免疫系统和获得性免疫系统的慢性激活会改变中枢神经系统的内稳态。
三、中枢免疫系统的实时成像
自1989年双光子激光扫描显微镜(TPLSM)问世以来,TPLSM已被用于检测中枢神经系统细胞功能和外周免疫细胞的驻留的动力学。这些研究有利于了解神经系统在健康和疾病状态下的运作方式。因此使用TPLSM对病毒入侵的免疫细胞进行实时成像,有利于了解免疫系统在病毒入侵情况下的运作规律。
1.脑组织成像前的准备
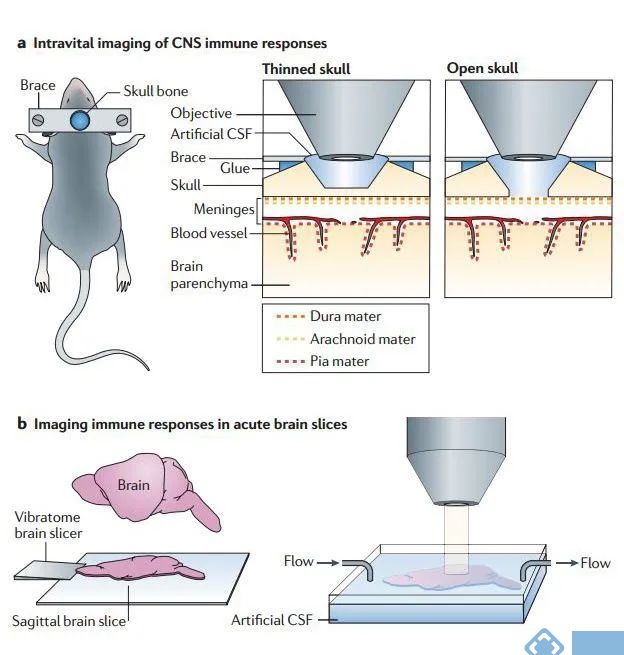
在用TPLSM对中枢神经系统进行成像时,需要考虑采用什么方式对脑组织进行成像。目前有三种活体脑组织进行成像方式:颅骨薄化、开颅手术和急性脑切片。
在TPLSM进行活体成像的过程中,大多数神经科学研究都采用开颅手术。即移除头骨上的一小块圆形区域,用一张盖玻片进行替代。然后使用直立的双光子显微镜通过颅窗成像直接观察脑膜和脑实质。相比之下,颅骨薄化只能建立一个半透明的观察窗,但这两种方法都限制了成像的深度。最大深度只能颅骨表面下200-400μm处进行成像,对于更深层次的大脑结构无法进行检测。
为了使用TPLSM对更深的大脑区域进行成像,可以制备急性脑切片进行成像,使用Vibratome95提取并切割脑组织,然后,将脑片放置在一个成像室中,在室温下用氧饱和的人工脑脊液进行孵育,可用于研究健康和疾病状态下大脑中的细胞动力学特点。
图3. 中枢免疫系统的成像方式
2.小胶质细胞的作用
在使用TPLSM研究正常大脑和损伤后中枢神经系统免疫细胞的动力学特点时,发现小胶质细胞的作用尤为特殊。在稳态条件下,小胶质细胞的动力学过程是高度动态的。这些细胞以特定的速度伸展和收缩,在几个小时内对整个脑实质进行一次监测。小胶质细胞的高度移动使它们能够清除细胞碎片和死亡细胞,并对中枢神经系统的病原体入侵做出快速反应。这种快速反应是由于小胶质细胞表达的嘌呤能受体(如P2Y12)能对损伤细胞释放到细胞外的二磷酸腺苷(ADP)和三磷酸腺苷(ATP)做出响应。
3.病毒感染的可视化
在神经系统,TPLSM的研究主要集中在自身免疫疾病、神经胶质损伤和寄生虫感染期间的免疫反应,但也有一些研究对嗜神经性病毒感染的免疫反应进行了可视化检测。
最近使用TPLSM发现水泡性口炎病毒(VSV)驻留在引流淋巴结囊下窦的巨噬细胞。VSV是一种溶解细胞的负链RNA病毒,皮下接种VSV后,VSV定位于引流淋巴结囊下窦巨噬细胞。然而,如果这些巨噬细胞在接种前被耗竭,病毒就会进入淋巴结内的周围神经,传播到中枢神经系统,并在7-10天内导致致命的神经麻痹。该项研究表明,包膜下窦巨噬细胞通过分泌I型IFN和募集浆细胞样树突状细胞(pDC)到被膜下窦,来阻止VSV通过周围神经进入CNS。因此,先天免疫细胞可以通过保护周围神经,进而保护中枢神经系统免受嗜神经病毒感染。
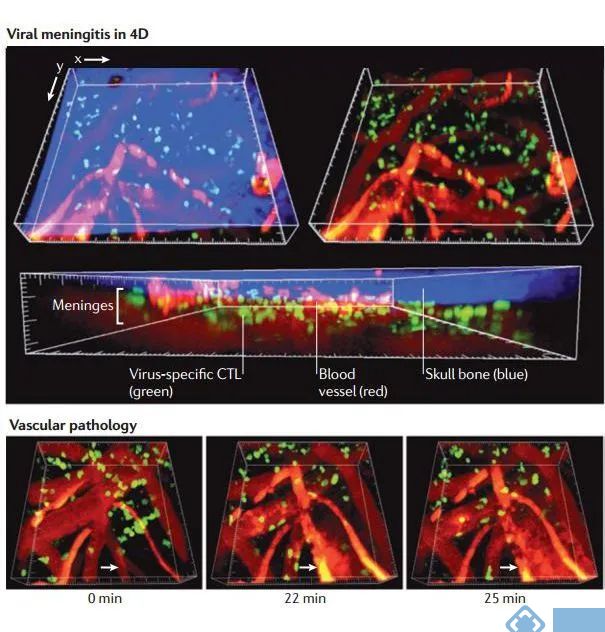
图4. 病毒性脑膜炎感染的实时成像
四、展望
在对病毒感染神经系统问题的研究上,我们正步入一个崭新的时代。通过新的研究工具,我们可以实时观察嗜神经性病毒如何感染神经元和如何诱导免疫反应。研究发现病毒通常通过外周进入神经系统入侵中枢系统,而在引流的淋巴结内,固有免疫细胞的存在可阻止嗜神经病毒进入周围神经系统,可避免致命的中枢神经系统疾病。然而,关于固有免疫细胞的动态免疫过程,和固有免疫细胞是否也能阻止病毒进入非淋巴组织的周围神经,仍需要更多的研究。
一旦病毒进入中枢神经系统,就必须考虑其发病机制,而实时成像在这方面大有用途。TPLSM可以在脑实质微环境中对不同病毒入侵响应的固有免疫细胞进行精细化研究。
病毒在神经系统的持续性感染和潜伏性是TPLSM尚未探索的另一个前沿领域。持续的病毒感染可以破坏中枢神经系统的动态平衡并导致神经功能障碍,但目前人们对导致这种功能障碍的具体机制知之甚少。病毒一旦在神经系统中进入潜伏期,就会在病毒感染和适应性免疫中建立相对良性的平衡关系。而对病毒潜伏期的动态过程和确切机制的探索,有利于获得维持病毒潜伏所需的免疫参数,可有效开发针对病毒潜伏期的治疗性疫苗。对病毒感染的持续期和潜伏期的的进一步细化,对于在不破坏体内免疫平衡的情况下,通过对病毒反应的特异性抑制来治疗病毒感染有着至关重要的作用。
扫码下载原文
我司重磅推出环路示踪,光遗传,钙记录,膜片钳,电生理等动物实验服务!
公司相关业务:
神经环路示踪病毒载体、基因编辑(敲入、敲除、点突变、敲低)、基因过表达/干扰服务、行为学小鼠模型构建、干细胞诱导分化、整包服务等。