01、新的变化
在我国现行的相关法规中,保健食品必须通过一定的注册备案程序才能顺利上市,而上市的产品又只能固定在《允许保健食品声称的功能目录》所规定的24类保健功能宣称当中,如果想宣称具备超出目录规定的新功能,则要首先申请调整总目录的适用范围,这一系列繁琐的流程使得我国成为世界上对保健食品监管最为严格的国家之一。
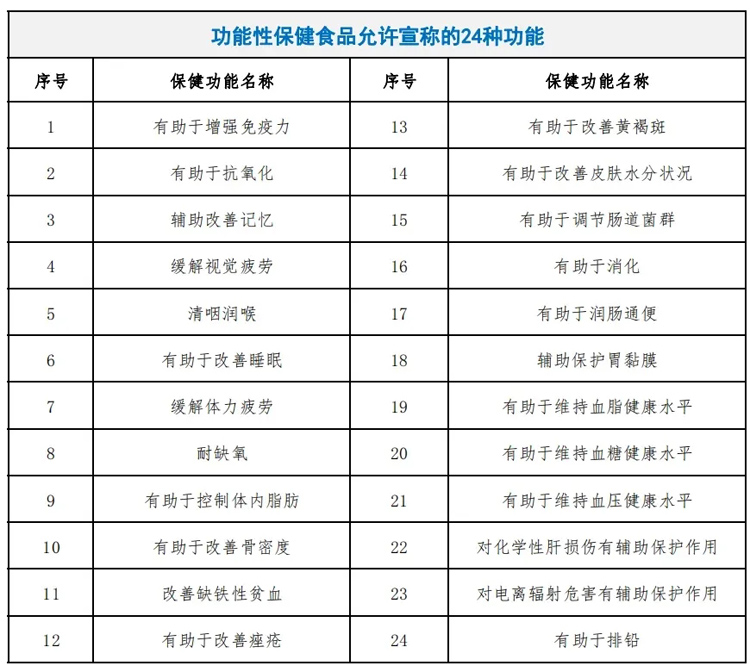
图:数据来源《允许保健食品声称的功能目录》
严格的监管体系自然有其所适应的时代背景,但在如今日新月异的大健康市场变化之下,桎梏的监管模式在一定程度上却阻碍了来自市场一线的创新热情;另一方面,依托跨境电商的火热加持,海外保健食品企业携带着具有新功能、新卖点的产品强势冲击着国内正陷于自我束缚的广阔市场空间,内外夹击之下使得本土大健康企业在差异化竞争领域变得愈发步履维艰。
2020年11月,一篇发表在《中国循证医学》杂志上题为“构建保健食品上市后技术评价证据体的思考”的文章引起了业内的广泛关注,同时也为新模式的诞生提供了些许契机。

图:文章来源《中国循证医学》杂志
文章有感于当前主流的动物实验和小样本量的人体试食试验很难在保健食品批准注册前准确地诠释保健食品的完整科学内涵,所以需要在上市后对商业规模生产的保健食品从安全性、保健功能等方面开展进一步的技术评价。然而从2016年《保健食品注册与备案管理办法》实施 3 年多以来申请产品延续注册时提交的上市后人群食用情况分析报告来看,保健食品上市后评价报告尚缺乏系统完善的证据支持。
2023年8月末,国家市场监督管理总局发布了《保健食品新功能及产品技术评价实施细则(试行)》,紧随其后又发布了《允许保健食品声称的保健功能目录 非营养素补充剂(2023年版)》及多份配套文件,其中变化最大的,就是允许企业在新功能正式纳入目录前,率先将产品上市。
允许保健产品的新功能在没有完全得以确认前先行推向市场的颠覆性变化,确实与我国数十年来坚持的传统有所出入,在一定程度上倒是与西方发达国家的监管思路相类似。将科学与市场相结合,让看得见的手更小一些,让看不见的手更大一些,将部分选择权交给处于一线的企业和消费者。
在新的机制下,保健食品企业可以大大缩短花费在行政程序上的时间就能投入新产品;同时,还可以更加容易地推出新功能产品,便于创新和迎接挑战,允许先上市意味着,只需要在上市前完成初步的技术评估,这远比之前的标准更容易完成,将会给许多保健食品企业提供非常具有可能性的广阔空间。
02、新的重点

第二十条:新功能保健食品批准上市的,注册人应当按照以下要求开展新功能保健食品上市后评价:
(一)制定新功能保健食品上市后评价方案,采集产品销售、人群消费、健康评价和投诉反馈等数据,开展消费人群及健康效应的综合分析,形成上市后评价年度自查报告。
(二)选取符合要求的食品检验机构或临床试验机构开展新功能评价方法评价,除按照延续注册要求提交资料外,在注册证书有效期届满6个月前,向食品审评中心提供不少于2家符合要求的食品检验机构或临床试验机构出具的新功能评价方法验证报告。
(三)根据自查报告和评价数据提出新功能上市后评价综述,以及评价方法和功能声称限定用语的优化调整建议和理由。
第二十一条:注册证书有效期届满,新功能保健食品上市后评价符合要求,需对功能目录和保健食品功能声称限定用语等相关内容进行调整的,食品审评中心将调整建议等相关材料报送国家市场监督管理总局。符合要求的,按程序调整。
第二十二条:注册人未按要求开展新功能保健食品上市后评价的,食品审评中心应当作出“建议不予注册”或取消新功能声称的延续注册审评结论,并报送国家市场监督管理总局。经核准后,注销新功能保健食品注册证书或取消新功能声称。
——第五章 上市后评价
尽管《保健食品新功能及产品技术评价实施细则(试行)》的施行极大缩短和便利以往保健食品企业将研发成果转化为上市产品的复杂周期,助推了大健康行业的产业创新热情,但从上述标黄条款的规定还是不难看出,国家对于上市后评价的相关条件还是相当严格,注册人一旦未按照要求开展人体试食试验或是评价机构不符合资质的,都将承担前期大量的技术、精力、时间和资金成本投入的功亏一篑。
作为保健食品功效评价和安全性研究的金标准,上市后评价采取人体试食试验的研究方式,就是以更高的标准要求企业本身,以高品质的产品服务消费者,从而祈望推动整个大健康行业的良性发展。
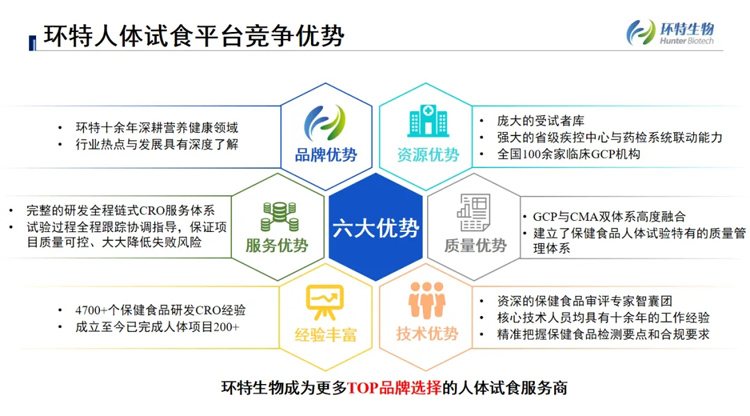
图:环特生物人体试食平台六大优势
环特生物基于数十年深厚科研积累,建立了以六大多维生物技术驱动的循证功效科学体系,并以处在体系最高维度的人体试食试验,覆盖保健食品领域数十项功效研究项目当中,建立了一站式全方位人体试食平台,为保健食品新功能的上市后再评价提供强大的技术支持和资源共享。
在广州,我们拥有超过2000平方米的人体功效临床研究中心,两大恒温恒湿实验分区,可同时容纳近三百名临床研究志愿者参与试验;在全国,我们与百余家临床GCP机构、三甲医院等开展深度合作,实现保健食品产学研的多维度融合。
今天,已经有越来越多的保健食品头部品牌选择环特生物开展人体试食研究服务。我们将人体试食作为功效评价的金标准,正是坚信这一份真金,是科学的真理如金,更是源自产品真实使用者的众口铄金。
03、新瓶更要装“旧酒”
我的产品不在法律规定的必须进行人体试食试验的范围之内,可以不做上市后评价吗?
我的产品功效已经经过其他模式动物实验证明了,还需要单独做人体试食试验吗?
尽管模式动物实验发展到今天已经历经了几个世纪的长足发展,但由于动物种属间的差异以及人群的个体差异, 实验结论的普适性和可靠性都会受到一定程度的限制。
这样的情况不仅仅只存在保健食品领域的范畴,在大部分需要验证产品对人的功效性和安全性的领域内,都有着模式动物实验结论和真实使用人群结果产生差异的案例,又由于缺乏人体试食以及未进行上市后再评价的细分研究, 许多企业未能及时对各自产品的特色与优势给予充分认识和定位。
此外,一些企业产品的功效宣称并不在上市后评价的强制性规定范围内,也会产生这样的疑虑:
上市后评价和人体试食试验真的非做不可吗?
与保健食品上市后评价的强制性规范不同,环特生物提出的产品上市后评价是以人体试食为核心,以循证功效为理论支持的普适性、前沿性产品评价方式。它并不单单限于宣称新功效的产品当中,而是包含了所有精准定位于真实人群使用效用的产品之内。
我们都知道产品由于配方不同、原理不同、剂量不同、工艺剂型不同等原因会对人体产生不同程度的正面或负面的影响,而探究影响本质的最主要依据便是真实人群的使用效果,这就需要在产品上市后通过人体试食研究对其进行客观、普适性的评价,才能建立更加科学、客观、多维的产品证据,从而为产品的科技营销提供强而有力的支持。
所谓新瓶装旧酒,用人体试食和产品上市后评价的新瓶装上功效宣称的旧酒,或许也能成为驰骋大健康新赛道的一叶方舟。
技术咨询请联系:17364531293(同微信)
